Substâncias Simples E Compostas – Química – Infoescola: a compreensão da distinção entre substâncias simples e compostas é fundamental para a química. Este estudo abrange a definição e as diferenças intrínsecas entre esses dois tipos de matéria, explorando suas composições atômicas, propriedades físicas e químicas, e as reações químicas em que estão envolvidas. A análise detalhada de exemplos do cotidiano e a classificação dessas substâncias, considerando suas estruturas moleculares e ligações químicas, proporcionarão uma base sólida para o entendimento da matéria.
Utilizaremos a tabela periódica como ferramenta principal para classificar as substâncias simples e analisaremos as diferentes ligações químicas (iônica, covalente, metálica) presentes nas substâncias compostas. A representação da estrutura molecular por meio de desenhos textuais auxiliará na visualização das ligações e na compreensão da geometria molecular. Finalmente, estudaremos exemplos de reações químicas, tanto de formação quanto de decomposição, para ilustrar a transformação da matéria e as mudanças nas propriedades das substâncias envolvidas.
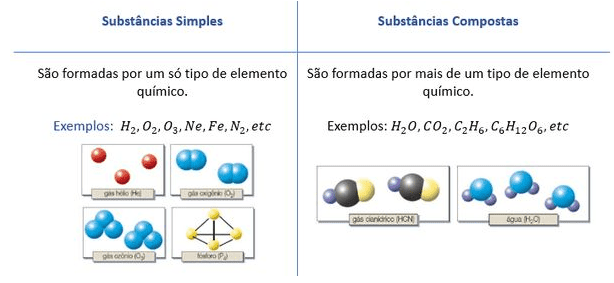
Definição e Diferenças entre Substâncias Simples e Compostas
Substâncias simples e compostas são categorias fundamentais na classificação da matéria em Química. A distinção entre elas reside na composição atômica: substâncias simples são formadas por átomos de um único elemento químico, enquanto substâncias compostas são formadas por átomos de dois ou mais elementos químicos diferentes, unidos quimicamente em proporções definidas. Esta diferença básica impacta significativamente suas propriedades físicas e químicas.
Composição Atômica de Substâncias Simples e Compostas
Substâncias simples são constituídas por átomos do mesmo elemento químico. Por exemplo, o oxigênio gasoso (O 2) é uma substância simples formada por duas moléculas diatômicas de oxigênio, cada uma contendo dois átomos de oxigênio ligados covalentemente. O ferro (Fe) também é uma substância simples, existindo como átomos de ferro individualmente ligados por forças metálicas. Já as substâncias compostas são formadas por átomos de diferentes elementos químicos unidos por ligações químicas, como iônicas ou covalentes.
A água (H 2O), por exemplo, é uma substância composta formada por dois átomos de hidrogênio e um átomo de oxigênio ligados covalentemente. O cloreto de sódio (NaCl), o sal de cozinha, é um exemplo de substância composta com ligação iônica, onde átomos de sódio e cloro se ligam através da atração eletrostática entre íons. A fórmula química representa a proporção fixa entre os átomos dos elementos que constituem a substância.
Propriedades Físicas e Químicas de Substâncias Simples e Compostas

As propriedades físicas, como ponto de fusão, ponto de ebulição, densidade e estado físico, variam significativamente entre substâncias simples e compostas. O oxigênio (O 2), por exemplo, é um gás à temperatura ambiente, enquanto o ferro (Fe) é um sólido. A água (H 2O), por sua vez, é líquida em condições normais de temperatura e pressão. As propriedades químicas também diferem consideravelmente.
A reatividade de uma substância simples pode ser muito diferente da reatividade de uma substância composta formada pelos mesmos elementos. Por exemplo, o hidrogênio (H 2) é um gás inflamável, enquanto a água (H 2O), apesar de conter hidrogênio, é um composto estável e não inflamável.
Comparação de Substâncias Simples e Compostas, Substâncias Simples E Compostas – Química – Infoescola
A tabela abaixo compara algumas substâncias simples e compostas, considerando seus nomes, fórmulas químicas e estados físicos à temperatura ambiente.
| Substância | Fórmula Química | Estado Físico (25°C e 1 atm) | Tipo |
|---|---|---|---|
| Oxigênio | O2 | Gasoso | Simples |
| Ferro | Fe | Sólido | Simples |
| Enxofre | S8 | Sólido | Simples |
| Cloro | Cl2 | Gasoso | Simples |
| Fósforo | P4 | Sólido | Simples |
| Água | H2O | Líquido | Composta |
| Cloreto de Sódio | NaCl | Sólido | Composta |
| Dióxido de Carbono | CO2 | Gasoso | Composta |
| Glicose | C6H12O6 | Sólido | Composta |
| Ácido Sulfúrico | H2SO4 | Líquido | Composta |
Exemplos e Classificações de Substâncias Simples e Compostas

A compreensão da classificação de substâncias como simples ou compostas é fundamental para o estudo da química. Esta classificação se baseia na composição da substância, ou seja, nos tipos de átomos que a constituem e nas ligações químicas que os unem. Substâncias simples são formadas por apenas um tipo de átomo, enquanto substâncias compostas são formadas por dois ou mais tipos de átomos, quimicamente unidos.
A seguir, apresentaremos exemplos e classificações detalhadas dessas substâncias.
Exemplos de Substâncias Simples e sua Classificação na Tabela Periódica
A tabela periódica organiza os elementos químicos de acordo com suas propriedades. A localização de um elemento na tabela indica suas características, incluindo sua tendência a formar ligações químicas. Os exemplos a seguir ilustram a diversidade de substâncias simples, categorizadas de acordo com sua posição na tabela periódica:
- Oxigênio (O 2): Não-metal, grupo 16.
- Nitrogênio (N 2): Não-metal, grupo 15.
- Cloro (Cl 2): Não-metal, grupo 17.
- Fósforo (P 4): Não-metal, grupo 15.
- Enxofre (S 8): Não-metal, grupo 16.
- Ferro (Fe): Metal, grupo 8.
- Alumínio (Al): Metal, grupo 13.
- Cobre (Cu): Metal, grupo 11.
- Ouro (Au): Metal, grupo 11.
- Hélio (He): Gás nobre, grupo 18.
Exemplos de Substâncias Compostas e seus Tipos de Ligações Químicas

Substâncias compostas apresentam diferentes tipos de ligações químicas, influenciando suas propriedades físicas e químicas. A seguir, são apresentados exemplos de substâncias compostas com indicação do tipo de ligação predominante:
- Cloreto de Sódio (NaCl): Ligação iônica.
- Água (H 2O): Ligação covalente.
- Dióxido de Carbono (CO 2): Ligação covalente.
- Metano (CH 4): Ligação covalente.
- Glicose (C 6H 12O 6): Ligação covalente.
- Sulfato de Cálcio (CaSO 4): Ligação iônica.
- Cloreto de Magnésio (MgCl 2): Ligação iônica.
- Amônia (NH 3): Ligação covalente.
- Ácido Clorídrico (HCl): Ligação covalente.
- Hidróxido de Sódio (NaOH): Ligação iônica e covalente.
Lista de Substâncias Simples e Compostas Classificadas
A classificação das substâncias em metálicas, não-metálicas, iônicas e covalentes facilita a compreensão de suas propriedades e comportamentos.
- Substâncias Simples Metálicas: Ferro (Fe), Alumínio (Al), Cobre (Cu), Ouro (Au).
- Substâncias Simples Não-Metálicas: Oxigênio (O 2), Nitrogênio (N 2), Cloro (Cl 2), Fósforo (P 4), Enxofre (S 8), Hélio (He).
- Substâncias Compostas Iônicas: Cloreto de Sódio (NaCl), Sulfato de Cálcio (CaSO 4), Cloreto de Magnésio (MgCl 2), Hidróxido de Sódio (NaOH).
- Substâncias Compostas Covalentes: Água (H 2O), Dióxido de Carbono (CO 2), Metano (CH 4), Glicose (C 6H 12O 6), Amônia (NH 3), Ácido Clorídrico (HCl).
Estrutura Molecular de Três Substâncias Compostas
A representação da estrutura molecular auxilia na visualização das ligações químicas e na compreensão das propriedades da substância.
Água (H2O): A molécula de água possui uma geometria angular. O átomo de oxigênio está no centro, ligado a dois átomos de hidrogênio por ligações covalentes. A representação pode ser feita como:
H-O-H
Dióxido de Carbono (CO2): A molécula de dióxido de carbono é linear, com o átomo de carbono no centro, ligado a dois átomos de oxigênio por ligações duplas covalentes. A representação pode ser feita como:
O=C=O
Metano (CH4): A molécula de metano apresenta uma geometria tetraédrica, com o átomo de carbono no centro, ligado a quatro átomos de hidrogênio por ligações covalentes simples. A representação pode ser feita como:
H
|
H-C-H
|
H
Reações Químicas Envolvendo Substâncias Simples e Compostas: Substâncias Simples E Compostas – Química – Infoescola
As reações químicas são processos que envolvem a transformação de substâncias, alterando suas propriedades e composição. Essas transformações podem ocorrer entre substâncias simples, substâncias compostas ou uma combinação de ambas. A compreensão dessas reações é fundamental para a química, permitindo a previsão e o controle de processos químicos em diversas áreas, desde a indústria até a biologia.
Formação de uma Substância Composta a partir de Substâncias Simples
Um exemplo clássico de reação química que envolve a formação de uma substância composta a partir de substâncias simples é a reação de síntese entre hidrogênio (H₂) e oxigênio (O₂), formando água (H₂O). Esta reação, representada pela equação química
2H₂(g) + O₂(g) → 2H₂O(l)
, é uma reação de combustão exotérmica, liberando calor. Nessa reação, duas substâncias simples, o hidrogênio gasoso e o oxigênio gasoso, combinam-se para formar uma substância composta, a água líquida. A reação requer uma energia de ativação, que pode ser fornecida por uma faísca ou chama, para iniciar o processo. Após o início, a reação prossegue espontaneamente, liberando energia na forma de calor e luz.
Decomposição de uma Substância Composta em Substâncias Simples
A eletrólise da água é um exemplo de reação de decomposição que transforma uma substância composta em substâncias simples. Aplicando uma corrente elétrica à água, ela se decompõe em seus elementos constituintes: hidrogênio e oxigênio. A equação química que representa essa reação é
2H₂O(l) → 2H₂(g) + O₂(g)
. Nesta reação, a energia elétrica é utilizada para quebrar as ligações químicas entre os átomos de hidrogênio e oxigênio na molécula de água, gerando as substâncias simples hidrogênio e oxigênio, ambos no estado gasoso. Esta é uma reação endotérmica, ou seja, absorve energia para ocorrer.
Comparação de Reações Químicas
Comparando a reação de síntese da água com a eletrólise da água, observamos diferenças significativas. Na síntese, duas substâncias simples (H₂ e O₂) reagem para formar uma substância composta (H₂O), liberando energia (reação exotérmica). Já na eletrólise, uma substância composta (H₂O) é decomposta em duas substâncias simples (H₂ e O₂), absorvendo energia (reação endotérmica). Os reagentes e produtos são invertidos, e o fluxo de energia é oposto.
Ambas as reações demonstram a capacidade das substâncias simples e compostas de se transformarem em outras substâncias através de reações químicas, ilustrando a lei da conservação da massa.
Fluxograma da Formação da Água
A formação da água a partir de hidrogênio e oxigênio pode ser representada pelo seguinte fluxograma:Início → Mistura de H₂(g) e O₂(g) → Fornecimento de energia de ativação (faísca) → Quebra de ligações em H₂ e O₂ → Formação de ligações entre H e O → Formação de H₂O(l) → Liberação de calor → Fim
Em resumo, a distinção entre substâncias simples e compostas reside na sua composição atômica: as simples são formadas por um único tipo de átomo, enquanto as compostas são formadas por dois ou mais tipos de átomos, unidos por ligações químicas. Compreender as propriedades e reações químicas dessas substâncias é crucial para o desenvolvimento de diversos campos, desde a medicina até a engenharia de materiais.
A análise realizada neste estudo demonstra a importância da classificação e da compreensão da estrutura molecular para prever o comportamento químico de diferentes substâncias.

