30 Exemplos De Substâncias Simples E Compostas: embarque conosco nessa fascinante exploração do mundo microscópico! A química, muitas vezes vista como um universo de fórmulas complexas, revela-se, na verdade, uma teia intrigante de elementos e compostos que moldam nosso mundo. Desvendaremos a diferença fundamental entre substâncias simples e compostas, analisando suas propriedades e aplicações, desde a indústria pesada até o nosso cotidiano.
Prepare-se para uma jornada de descobertas, onde cada átomo e cada molécula contam uma história.
Através de exemplos práticos e descrições detalhadas, vamos desvendar o mistério por trás da formação das substâncias, explorando suas ligações químicas e propriedades únicas. Aprenderemos a identificar e nomear essas substâncias, compreendendo as regras que regem a nomenclatura química. Esta jornada não é apenas uma exploração de conceitos científicos; é uma imersão no próprio cerne da matéria, revelando a beleza e a complexidade do universo químico que nos rodeia.
Classificação de Substâncias: 30 Exemplos De Substâncias Simples E Compostas
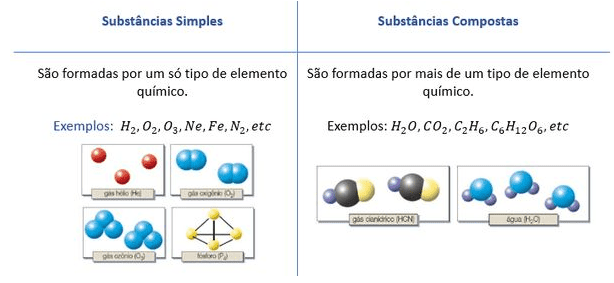
A química, em sua imensa riqueza, organiza a matéria em categorias para facilitar a compreensão de suas propriedades e comportamentos. Uma das classificações mais fundamentais distingue as substâncias em simples e compostas, uma divisão que revela a essência da composição atômica de cada material. Esta distinção, aparentemente simples, abre portas para um universo de propriedades e reações químicas fascinantes.
Substâncias simples são formadas por átomos de um único elemento químico. Já as substâncias compostas resultam da combinação de átomos de dois ou mais elementos químicos, unidos por ligações químicas, formando uma nova estrutura com propriedades distintas daquelas dos elementos que a compõem. Esta diferença fundamental na composição define suas características e comportamentos, abrindo caminho para uma compreensão mais profunda do mundo que nos cerca.
Substâncias Simples e Compostas: Uma Tabela Comparativa, 30 Exemplos De Substâncias Simples E Compostas
A seguir, apresentamos uma tabela com 30 exemplos de substâncias, classificadas como simples ou compostas, juntamente com suas fórmulas químicas. Cada entrada representa uma jornada microscópica, revelando a dança dos átomos que compõem a matéria macroscópica que observamos diariamente.
| Substância | Tipo | Fórmula Química | Estado Físico (25°C e 1 atm) |
|---|---|---|---|
| Oxigênio | Simples | O2 | Gasoso |
| Hidrogênio | Simples | H2 | Gasoso |
| Nitrogênio | Simples | N2 | Gasoso |
| Enxofre | Simples | S8 | Sólido |
| Fósforo | Simples | P4 | Sólido |
| Cloro | Simples | Cl2 | Gasoso |
| Bromo | Simples | Br2 | Líquido |
| Iodo | Simples | I2 | Sólido |
| Ferro | Simples | Fe | Sólido |
| Cobre | Simples | Cu | Sólido |
| Alumínio | Simples | Al | Sólido |
| Ouro | Simples | Au | Sólido |
| Prata | Simples | Ag | Sólido |
| Mercúrio | Simples | Hg | Líquido |
| Carbono | Simples | C | Sólido |
| Água | Composta | H2O | Líquido |
| Glicose | Composta | C6H12O6 | Sólido |
| Sal de cozinha | Composta | NaCl | Sólido |
| Dióxido de carbono | Composta | CO2 | Gasoso |
| Metano | Composta | CH4 | Gasoso |
| Amônia | Composta | NH3 | Gasoso |
| Ácido sulfúrico | Composta | H2SO4 | Líquido |
| Álcool etílico | Composta | C2H5OH | Líquido |
| Ácido clorídrico | Composta | HCl | Gasoso |
| Cloreto de sódio | Composta | NaCl | Sólido |
| Óxido de ferro (III) | Composta | Fe2O3 | Sólido |
| Hidróxido de sódio | Composta | NaOH | Sólido |
| Ácido acético | Composta | CH3COOH | Líquido |
| Sacarose | Composta | C12H22O11 | Sólido |
Comparação de Propriedades Físicas

A comparação das propriedades físicas, como ponto de fusão, ponto de ebulição e estado físico à temperatura ambiente, ilumina as diferenças intrínsecas entre substâncias simples e compostas. Estas propriedades são reflexo direto das forças intermoleculares e da estrutura cristalina, que variam significativamente dependendo da composição atômica.
Observe a comparação abaixo, considerando condições normais de temperatura e pressão (CNTP):
Substâncias Simples:
- Oxigênio (O2): Ponto de fusão: -218°C; Ponto de ebulição: -183°C; Estado físico: Gasoso.
- Ferro (Fe): Ponto de fusão: 1538°C; Ponto de ebulição: 2862°C; Estado físico: Sólido.
- Cloro (Cl2): Ponto de fusão: -101°C; Ponto de ebulição: -34°C; Estado físico: Gasoso.
- Enxofre (S8): Ponto de fusão: 115°C; Ponto de ebulição: 445°C; Estado físico: Sólido.
- Mercúrio (Hg): Ponto de fusão: -39°C; Ponto de ebulição: 357°C; Estado físico: Líquido.
Substâncias Compostas:
- Água (H2O): Ponto de fusão: 0°C; Ponto de ebulição: 100°C; Estado físico: Líquido.
- Sal de cozinha (NaCl): Ponto de fusão: 801°C; Ponto de ebulição: 1413°C; Estado físico: Sólido.
- Dióxido de carbono (CO2): Ponto de fusão: -78°C (sublimação); Ponto de ebulição: -78°C (sublimação); Estado físico: Gasoso.
- Álcool etílico (C2H 5OH): Ponto de fusão: -114°C; Ponto de ebulição: 78°C; Estado físico: Líquido.
- Glicose (C6H 12O 6): Ponto de fusão: 146°C (decompõe-se); Ponto de ebulição: não aplicável (decompõe-se); Estado físico: Sólido.

